

近日,我院徐凌飞教授团队在Nature Plants上发表题为“Naturally impaired side-chain shortening of aromatic 3-ketoacyl-CoAs reveals the biosynthetic pathway of plant acetophenones”的研究论文。该成果利用梨属不同种资源揭示苯乙酮类物质的完整生物合成途径。这是梨领域首篇发表于该期刊的研究论文。

苯乙酮及其衍生物在植物界和微生物界中分布广泛,具有多样的生物学功能。苯乙酮及其衍生物在药物研发中扮演重要角色,比如针对关节炎的AP-PA疗法已在临床获得应用。在植物界,苯乙酮(acetophenone)是茶花和可可豆的主要特征香气物质之一,苯乙酮类物质piceol和pungenol是云杉抵御云杉卷叶蛾危害的关键化学防御物质,而植物转基因实验常被用来提高农杆菌侵染效率的乙酰丁香酮(acetosyringone),也是一种从烟草中鉴定出的苯乙酮类化合物。更加有趣的是,人类和一些哺乳动物的皮肤微生物群落不仅能合成苯乙酮类物质,这类物质近年来还被证明能够显著吸引蚊虫,是蚊虫偏爱某些人群的‘元凶’之一。 尽管苯乙酮及其衍生物的生物学功能已被充分报道,但其生物合成途径仍有待阐明。
研究团队首先从砀山酥梨叶片中分离并鉴定出对羟基苯乙酮(云杉素,piceol)的糖基化衍生物云杉苷(picein),进一步研究发现该化合物主要在亚洲梨(白梨种、砂梨种、秋子梨种)叶片中积累,在西洋梨与新疆梨中几乎检测不到。鉴于梨属植物遗传背景高度杂合且种间杂交无生殖隔离,团队推测以云杉苷含量差异显著的亲本进行杂交,其F1代群体或出现符合孟德尔遗传定律的性状分离,可作为定位苯乙酮合成关键基因的突破口。
为此团队调查多个梨种间杂交F1代群体的云杉苷积累情况,发现其符合单基因控制的隐性性状遗传分离比,并由此定位到一个β-氧化途径中关键酶KAT(3-ketoacyl-CoA thiolase)的编码基因。结合已报道的KAT反应底物与前人预测的苯乙酮合成前体一致的特征,团队揭示了一种特殊的代谢分流机制:当KAT活性受限时,β-氧化途径会重新导向苯乙酮合成途径。
为完整解析该机制,团队进一步探究了 β- 氧化途径中另外两个核心酶 CHD(cinnamoyl-CoA hydratase-dehydrogenase)和TE(thioesterase)在苯乙酮合成中扮演的角色。结果显示,KAT 功能受限时,CHD可将4-香豆酰-CoA(4CA-CoA)转化为4-hydroxy-3-oxo-3-phenylpropanoyl CoA(4H3O3PP-CoA),该物质再经 TE 催化水解形成4-hydroxy-3-oxo-3-phenylpropionic acid,进而自发脱羧生成云杉素。此外,团队通过同源进化分析发现,自然界中苯乙酮的生物合成模式与人类利用代谢工程生产甲基酮类化合物的策略不谋而合。
最后,团队还筛选出负责催化云杉素糖基化生成云杉苷的糖基转移酶(PiGT),揭示了云杉苷生物合成完整路径的最后一步。该研究不仅揭示了植物苯乙酮类化合物的完整生物合成途径,为植物次生代谢机制研究提供了新视角,也为后续苯乙酮类物质的代谢工程应用及梨属植物的遗传改良奠定了重要理论基础。
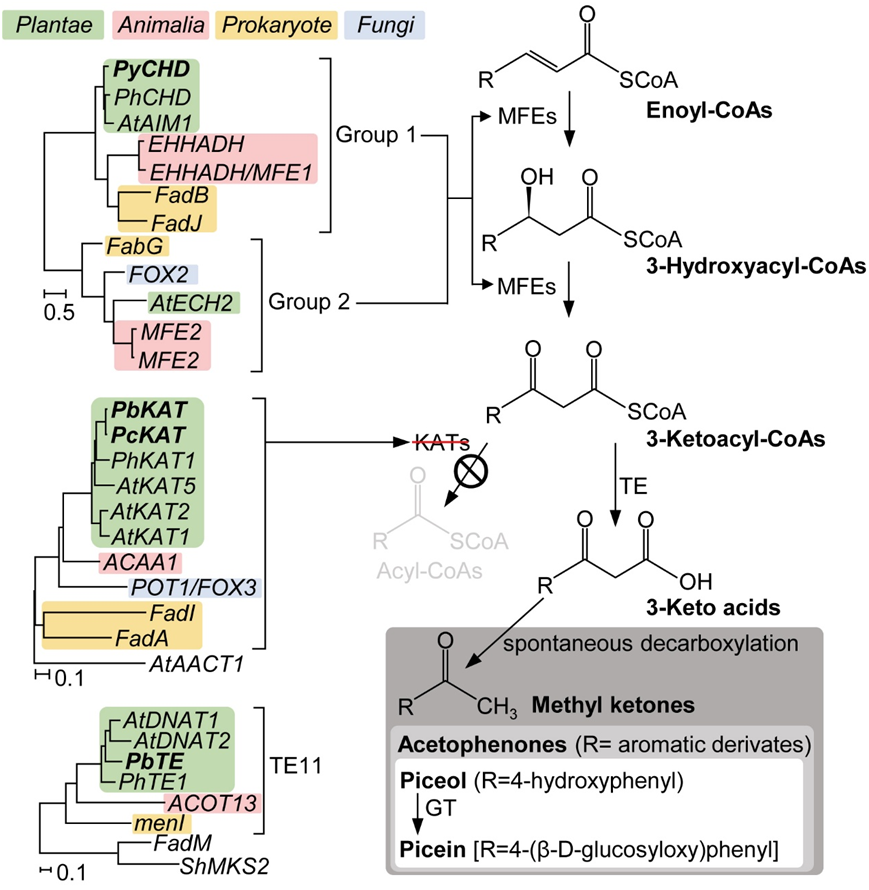
苯乙酮与其他甲基酮类物质合成通路的比较分析
我院翟锐副教授、在读博士生张红娟和青年教授谢银鹏为论文共同第一作者,徐凌飞教授与李鹏民教授为共同通讯作者,马锋旺教授、管清美教授、张静研究员,新西兰生物产业科学院(Bioeconomy Science Institue)Ross Atkinson 博士及深圳大学杜璇教授对本研究做出了重要贡献。
原文链接:https://www.nature.com/articles/s41477-025-02082-x